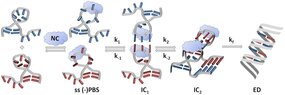
Les interconversions entre structures d'acide nucléique sont généralement favorisées par des protéines chaperonnes et jouent un rôle important en biologie. Le FRET est largement utilisé pour suivre ces interconversions, principalement par le biais d'expériences d’écoulement à flux bloqué qui ne fournissent qu'une moyenne pondérée de l'émission de toutes les espèces en solution. En collaboration avec l'équipe de J. Leonard (IPCMS, Strasbourg), cette limitation a été levée en combinant la fluorescence résolue en temps (TRF) avec la microfluidique en gouttelettes (DmF). Nous avons validé cette approche en étudiant l'hybridation des séquences d'amorce (PBS) du VIH-1 (+)/(-) promue par la protéine de nucléocapside du VIH-1. L’approche TRF-DmF nous a permis de suivre l'évolution temporelle des espèces en réaction et a révélé un intermédiaire précoce jamais identifié jusqu'à présent. TRF-DmF se compare également favorablement aux expériences en molécules uniques, offrant un contrôle précis des concentrations, sans besoin de greffer un partenaire sur une surface et sans photoblanchiment.
Référence : Kinetics of protein-assisted nucleic acid interconversion monitored by transient time resolved fluorescence in microfluidic droplets. Grytsyk N, Cianfarani D, Crégut O, Richert L, Boudier C, Humbert N, Didier P, Mély Y, Léonard J.
Nucleic Acids Res. 2021 Aug 27;gkab687. DOI: 10.1093/nar/gkab687